* DISTRIBUIÇÃO ELETRÔNICA
- Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas: K,L,M,N,O,P e Q.
- À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
- As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
- Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
Nível de energia
|
Camada
|
Número máximo de elétrons
|
1º
|
K
|
2
|
2º
|
L
|
8
|
3º
|
M
|
18
|
4º
|
N
|
32
|
5º
|
O
|
32
|
6º
|
P
|
18
|
7º
|
Q
|
2
|
- Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
- O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
- O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível.
- Assim, como no 1º nível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons.
- O subnível s do 1º nível de energia é representado por 1s.
- Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 | 7s 7p |
Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.
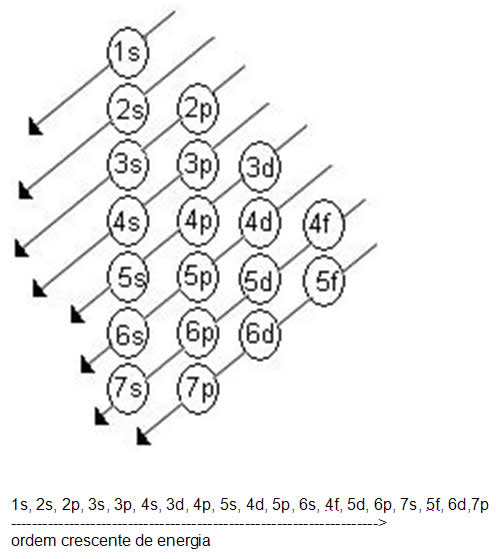
- Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
O símbolo "Z" corresponde ao número atômico, que é a quantidade de prótons que o átomo possui em seu núcleo. Quando o átomo está no estado fundamental, a quantidade de prótons é igual à quantidade de elétrons. Assim, se Z=25, isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Resposta: K=2; L=8; M=18; N=18; O=8
(Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling).


Nenhum comentário:
Postar um comentário